- Sergio Vargas Jimenez
- Christian Espinoza Herreros
- Ruben Bermejo Lopez
- Christian Vega Castro
- Antonio Melendres Calderon

- El átomo es la mínima cantidad de materia de un elemento químico.
- Es la unidad mas pqueña de la materia, que ya no se puede dividir, solo con procesos quimicos.


EL ATOMO EN LA ANTIGUEDAD:
Escuela Atomista (2500 a.C.)
Durante los siglos VI a IV antes de Cristo, en las ciudades griegas surgió una nueva mentalidad, una nueva forma de ver el mundo, cómo una inmensa máquina gobernada por unas leyes fijas e inmutables que el hombre podía llegar a comprender. Es así como los filósofos Leucipo y Demócrito, idearon que la materia era divisible hasta la partícula denominada ÁTOMO (indivisible).


Empendocles

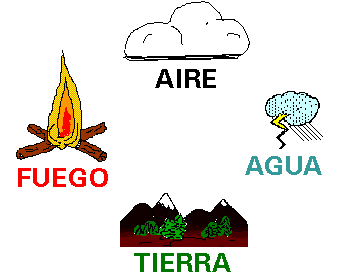
En el siglo IV a. C., Empédocles postuló que la materia estaba formada por 4 elementos: tierra, aire, agua y fuego.
Aristoteles

Aristóteles, posteriormente, postula que la materia estaba formada por esos 4 elementos pero niega la idea de átomo, hecho que se mantuvo hasta 200 años después en el pensamiento de la humanidad.
Teorias Atomicas
Teoría de Jhon Dalton
Jhon Dalton:

Biografia:
Teoría de Jonhn Dalton
En 1808, John Dalton publicó su teoría atómica, que retomaba las antiguas ideas de Leucipo y de Demócrito.
Según la teoría de Dalton:
- Los elementos están formados por partículas diminutas, indivisibles e inalterables llamadas átomos.

- Los átomos de un mismo elemento son iguales entre sí tanto en masa como en propiedades físicas y químicas.
- Los átomos de elementos diferentes son distintos en cuanto a masa y demás propiedades.
- Los compuestos se forman por la unión de átomos de los elementos correspondientes, en una relación numérica sencilla.
Dalton estableció un sistema para designar a cada átomo de forma que se pudieran distinguir entre los distintos elementos:

Modelo Atomico de Dalton
Los elementos están formados por partículas diminutas, indivisibles e inalterables llamadas átomos.

- Un átomo es la partícula más pequeña de un elemento que conserva sus propiedades.

- Un elemento es una sustancia pura que está formada por átomos iguales.

- Un compuesto es una sustancia que está formada por átomos distintos combinados en una relación numérica sencilla y constante.
EL ATOMO ES DIVISIBLE
Una vez aceptada la teoría atómica de la materia, los fenómenos de electrización y electrólisis pusieron de manifiesto, por un lado, la naturaleza eléctrica de la materia y, por otro, que el átomo era divisible; es decir, que estaba formado por otras partículas fundamentales más pequeñas.
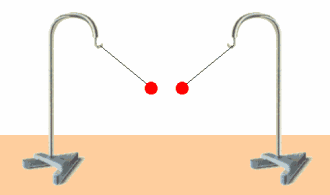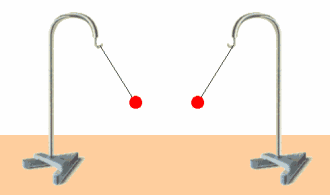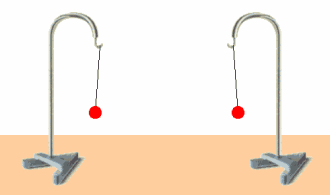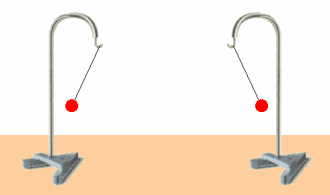
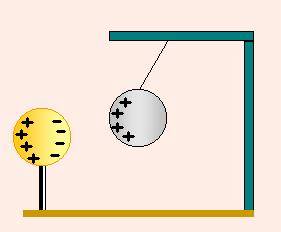
Los fenómenos eléctricos son una manifestación de su carga eléctrica. La unidad de carga eléctrica en el SI es el culombio (C).
Hay 2 tipos de cargas eléctricas: positiva y negativa. dos cuerpos que hayan adquirido una carga del mismo tipo se repelen, mientras que si poseen carga de distinto tipo se atraen.
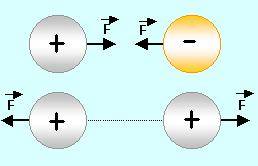
La materia es eléctricamente neutra, es decir, tiene la misma cantidad de cada tipo de carga. cuando adquiere carga, tanto positiva como negativa, es porque tiene más cantidad de un tipo que de otro.
A finales del siglo XIX y principios del XX, una serie de experimentos permitieron identificar las partículas responsables de la carga negativa (el electrón) y de la carga positiva (el protón).
Estos experimentos proporcionaron los datos siguientes sobre la estructura de la materia:
- El átomo contiene partículas materiales subatómicas.
- Los electrones tienen carga eléctrica negativa y masa. Cada electrón posee una carga eléctrica elemental.
- Los protones tienen carga eléctrica positiva y mayor masa.

- Como el átomo es eléctricamente neutro, hay que suponer que el número de cargas eléctricas negativas (electrones) es igual al número de cargas positivas (protones).

J.J.Thonson:

Biografia:
Teoria de J.J Thomson

El modelo atómico de Thompson (1856-1940) postula que el átomo se compone de una esfera cargada positivamente en la que reside la mayor parte de la masa del átomo y sobre la cual se incrustan los electrones.

Realiza una serie de experimentos con gases, descubre unas partículas cargadas negativamente a las que llama electrones. Según él la materia es eléctricamente neutra. Su modelo considera al átomo como una masa con carga positiva, donde se insertan los electrones en número y posiciones tales que el campo eléctrico resultante es nulo. “El modelo del pastel de pasas”.
Este modelo permitía explicar varios fenómenos experimentales como la electrización y la formación de iones.
- La electrización: Es el exceso o la deficiencia de electrones que tiene un cuerpo y es la responsable de su carga eléctrica negativa o positiva.
- La formación de iones: Un ion es un átomo que ha ganado o ha perdido electrones. Si gana electrones tiene carga neta negativa y se llama anión y si pierde electrones tiene carga neta positiva y se llama catión.

Modelo Atomico de J.J.Thomson
- “El modelo del pastel de pasas”.

Teoria Atomica de Rutherford
Ernest Rutherford:

Teoria de Ernest Rutherford

- El átomo tiene un núcleo central en el que están concentradas la carga positiva y casi toda la masa.
- La carga positiva de los protones del núcleo se encuentra compensada por la carga negativa de los electrones, que están fuera del núcleo.
- Los electrones giran a mucha velocidad alrededor del núcleo y están separados de éste por una gran distancia.

El modelo de Thomson tuvo una gran aceptación hasta que, en 1911, el químico y físico inglés Ernest Rutherford y sus colaboradores llevaron a cabo el "Experimento de Rutherford".
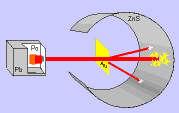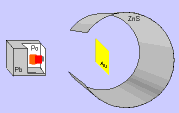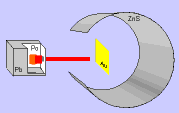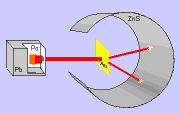
Este experimento ofrecía unos resultados que no podían explicarse con el modelo de átomo que había propuesto Thomson y, por tanto, había que cambiar el modelo.
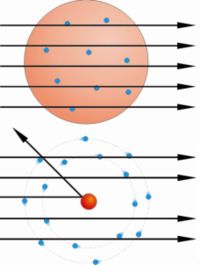
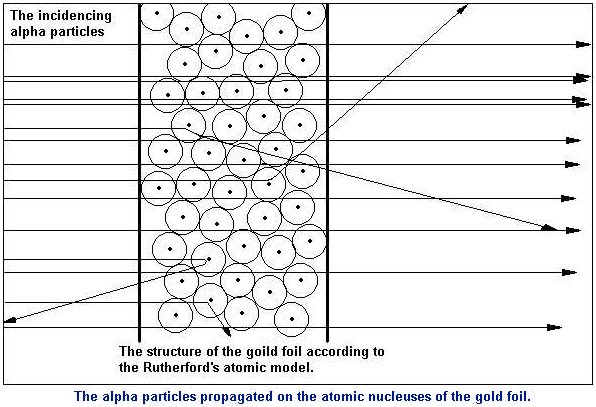
En el experimento se bombardeaba una fina lámina de oro con partículas alfa (positivas) procedentes de un material radiactivo y se observaba que:
- La mayor parte de las partículas alfa atravesaban la lámina sin cambiar de dirección, como era de esperar.
- Algunas partículas alfa se desviaron considerablemente.
- Unas pocas partículas alfa rebotaron hacia la fuente de emisión.
Los Neutrones
- La masa de protones y electrones no coincidía con la masa total del átomo; por tanto, Rutherford supuso que tenía que haber otro tipo de partículas subatómicas en el núcleo de los átomos.
- Estas partículas fueron descubiertas en 1933 por J. Chadwick. Al no tener carga eléctrica recibieron el nombre de neutrones.
- Los neutrones son partículas sin carga y de masa algo mayor que la masa de un protón.

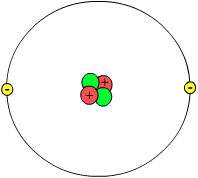
Estructura del átomo
Según esto, el átomo quedó constituido así:
- Una zona central o NÚCLEO donde se encuentra la carga total positiva (la de los protones) y la mayor parte de la masa del átomo, aportada por los protones y los neutrones.
- Una zona externa o CORTEZA donde se hallan los electrones, que giran alrededor del núcleo.
- Hay los mismos electrones en la corteza que protones en el núcleo, por lo que el conjunto del átomo es eléctricamente neutro.
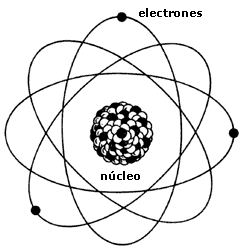
Teoria Atomica de Niels Bohr
Niles Bohr:

Biografia:
Teoria Atomica de Niels Bohr
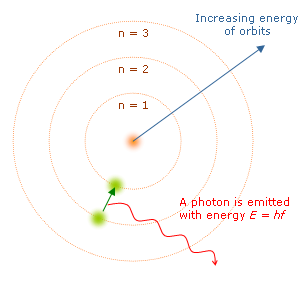
El modelo atómico de Bohr contempla cuatro postulados:
- Los electrones en los átomos están localizados en órbitas o niveles de energía alrededor del núcleo.
- Los electrones en las órbitas más cercanas al núcleo tienen menor energía que aquellos localizados en órbitas más alejadas.
- Cualquier electrón en un átomo puede tener sólo ciertos valores de energía permitidos. Esta energía determina qué órbita ocupa un electrón.
- Los electrones pueden moverse de una órbita a otra. Para esto debe ganar o perder una cantidad exacta de energía, un cuanto de energía.

Distribucion de Elementos
De acuerdo con este nuevo modelo, alrededor del núcleo hay capas o niveles de energía:
- - En la primera capa se sitúan, como máximo, 2 electrones.
- - En la segunda capa se sitúan, como máximo, 8 electrones.
- - En la tercera capa se sitúan, como máximo, 18 electrones.
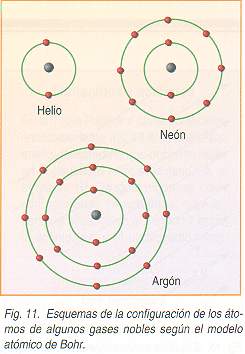
Ejemplos:
- 10Ne -> (2,8)
- 18Ar -> (2,8,8)
- 11Na -> (2,8,1)
- 15P -> (2,8,5)
Modelo Atomico de Bohr
- Niveles de Energia
